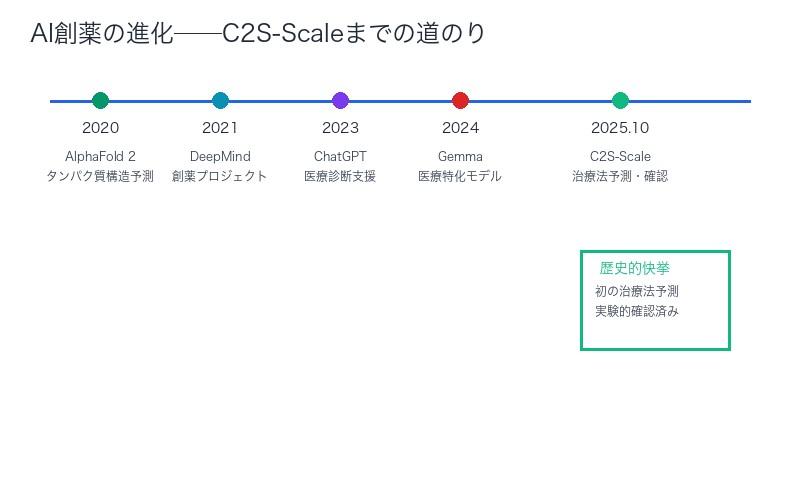
2025年10月15日、医療AIの歴史に新たな1ページが刻まれました。GoogleのC2S-Scaleモデルが、世界で初めて新しいがん治療法を予測し、実験的検証で確認に成功したのです。
発見されたのは、シルミタセルチブ(CX-4945)という既存薬の、これまで知られていなかった 「特定の免疫条件下でのみ抗原提示を強化する」という驚くべき性質。この発見は、腫瘍を免疫系にとって「見える」ようにする──つまり、がん細胞を免疫系が攻撃可能な標的に変えるという革命的な治療アプローチを開きました。
「すべてのがんが完全に治療可能になるまで、そう長くはかからないはずです」──この大胆な予測は、もはや夢物語ではありません。
X(Twitter)での反響:
「Let’s freaking go! This is so freaking huge(やったぞ!これは本当に巨大な出来事だ)」
– Chubby♨️ @kimmonismus(181,767閲覧、1,893いいね)
Google C2S-Scale、AIが初めて新しいがん治療法を予測──シルミタセルチブ発見の衝撃
2025年10月15日、Google ResearchはC2S-Scale(Cell to System Scale)という27Bパラメータのモデルを発表しました。このモデルは、Gemmaファミリーをベースにしたシングルセル分析特化型の基盤モデルです。
そして発表からわずか2日後、このモデルが達成した偉業が世界を驚かせました:
- シルミタセルチブ(CX-4945)という既存の薬剤が、特定の免疫条件下でのみ抗原提示を強化することを予測
- この予測を生細胞での実験的検証で確認
- AIモデルが生成した仮説が、実際の生物学的現象として再現された初めてのケース
Google公式ブログでは、研究リーダーのShekoofeh Azizi氏が次のように述べています:
Google公式発表より:
「C2S-Scaleは、がん細胞の挙動に関する新しい仮説を生成し、その予測を生細胞での実験的検証で確認しました。この結果は、新しい種類の生物学的発見の青写真を提供します──予測モデルが、コンテキストに依存した生物学を発見し、生物学的に根拠のある仮説を生成するほど強力であるということです。」
– 出典:Google Blog
この発見が革命的である理由は3つあります:
- AIが主導した発見:人間の研究者が見逃していた生物学的メカニズムをAIが予測
- 実験的確認済み:単なる仮説ではなく、実際の生細胞で再現された
- コンテキスト依存性の発見:「特定条件下でのみ」という条件付き効果を予測できた
27Bパラメータモデルが導いた生物学的仮説──実験的検証で確認済み
C2S-Scaleは、27億(27B)のパラメータを持つ基盤モデルです。この規模は、GPT-3.5(175B)やClaude Sonnet 4(推定200B+)と比較すると小さめですが、医療・生物学分野に特化したことで驚異的な性能を発揮しました。
| 項目 | C2S-Scale | 汎用LLM |
|---|---|---|
| パラメータ数 | 27B(270億) | 175B-200B+ |
| 特化領域 | シングルセル分析・がん生物学 | 汎用タスク |
| 実験的検証 | 生細胞で確認済み | 一般に未実施 |
| 発見のタイプ | コンテキスト依存の新規メカニズム | 既知知識の再構成 |
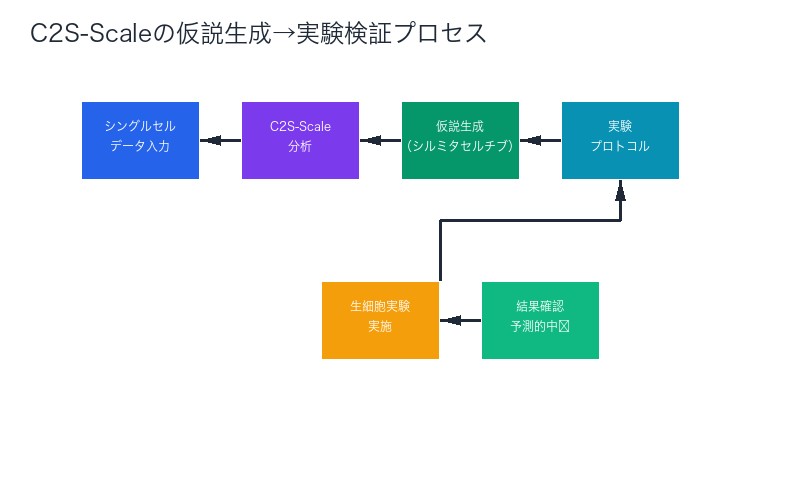
C2S-Scaleが生成した仮説は、次のような科学的プロセスで検証されました:
- 仮説生成:シルミタセルチブが特定の免疫条件下で抗原提示を強化する可能性を予測
- 実験設計:予測された条件を再現する実験プロトコルを作成
- 生細胞実験:実際のがん細胞と免疫細胞を用いた検証
- 結果確認:予測通り、特定条件下で抗原提示が強化されることを観察
この検証プロセスが重要なのは、AIの予測が単なる統計的推論ではなく、生物学的に意味のある現象だったことを証明したからです。
シルミタセルチブ(CX-4945)とは何か──免疫条件依存の抗原提示強化
シルミタセルチブ(CX-4945)は、もともとCK2(カゼインキナーゼ2)阻害剤として開発された既存の抗がん剤候補です。しかし、C2S-Scaleが発見したのは、これまで知られていなかった全く新しい作用機序でした。
発見された新メカニズム:
- 条件:特定の免疫環境が整っているとき(詳細条件は研究論文で公開予定)
- 効果:抗原提示の強化──がん細胞が免疫系に「見つかりやすく」なる
- 結果:免疫系の攻撃能力向上──T細胞などががん細胞を認識・攻撃
| 従来の理解 | C2S-Scaleの発見 |
|---|---|
| シルミタセルチブはCK2を阻害することでがん細胞の増殖を抑制 | 特定の免疫条件下で抗原提示を強化し、免疫系を活性化 |
| 直接的な抗がん作用のみを想定 | 免疫療法との併用で相乗効果の可能性 |
| 条件に関わらず一定の効果 | コンテキスト依存──条件により効果が変化 |
この「コンテキスト依存性」が、C2S-Scaleの予測能力の真骨頂です。従来の創薬研究では、「薬Aは常に効果Bを持つ」という単純な関係性を探していました。しかしC2S-Scaleは、「薬Aは条件Cが満たされたときのみ効果Bを持つ」という複雑な関係性を発見したのです。
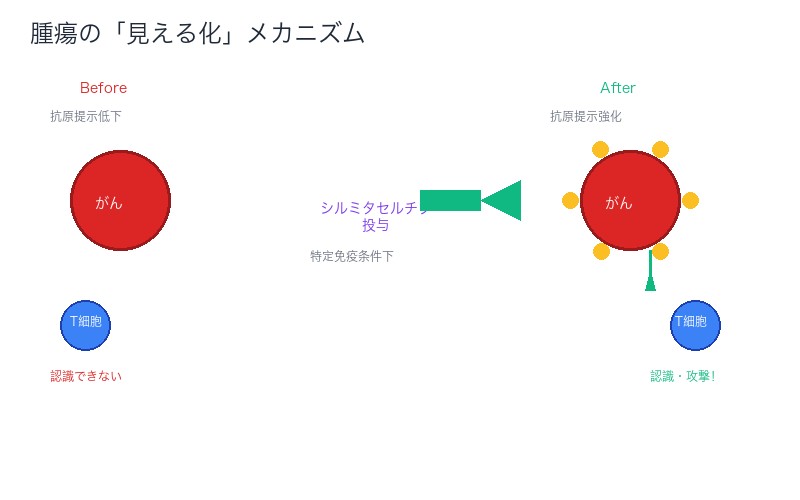
「腫瘍を見える化」する革命──免疫系が認識できるメカニズム
がん細胞が免疫系から逃れる最大の理由は、「見えない」からです。正確には、がん細胞は免疫系に認識されないように、抗原(目印)の提示を抑制しています。
シルミタセルチブの新発見メカニズムは、この「見えない状態」を「見える状態」に変えるスイッチのような働きをします。
抗原提示のメカニズム:
- 正常な細胞:MHC(主要組織適合性複合体)クラスIに抗原を提示
- がん細胞:MHC提示を減少させ、免疫系から「隠れる」
- シルミタセルチブ投与後(特定条件下):MHC提示が再び増加し、免疫系が「発見」
免疫療法との相乗効果:
この発見は、既存の免疫チェックポイント阻害剤(オプジーボ、キイトルーダなど)との併用で、劇的な治療効果向上が期待されます。
- 免疫チェックポイント阻害剤:T細胞の「ブレーキ」を解除
- シルミタセルチブ:がん細胞を「見える化」
- 相乗効果:ブレーキが解除されたT細胞が、見える化されたがん細胞を攻撃
コンテキスト依存の生物学──C2S-Scaleが解き明かした新しい発見の青写真
C2S-Scaleが示した「コンテキスト依存の生物学」という概念は、創薬研究に革命をもたらす可能性があります。
コンテキスト依存の生物学とは:
- 従来の生物学:「遺伝子Aがタンパク質Bを作る」という単純な因果関係
- コンテキスト依存の生物学:「遺伝子Aは、条件C1、C2、C3が満たされたときのみタンパク質Bを作る」という条件付き因果関係
この違いは、創薬において決定的です。なぜなら、多くの薬剤が臨床試験で失敗する理由は、「ある患者には効くが、別の患者には効かない」というコンテキスト依存性にあるからです。
| 従来の創薬アプローチ | C2S-Scale型アプローチ |
|---|---|
| 単一の標的に対する効果を評価 | 複数の条件下での効果を同時評価 |
| 平均的な効果を追求 | 条件依存の最大効果を発見 |
| 臨床試験で初めてコンテキスト依存性に気づく | 事前にコンテキストを予測・最適化 |
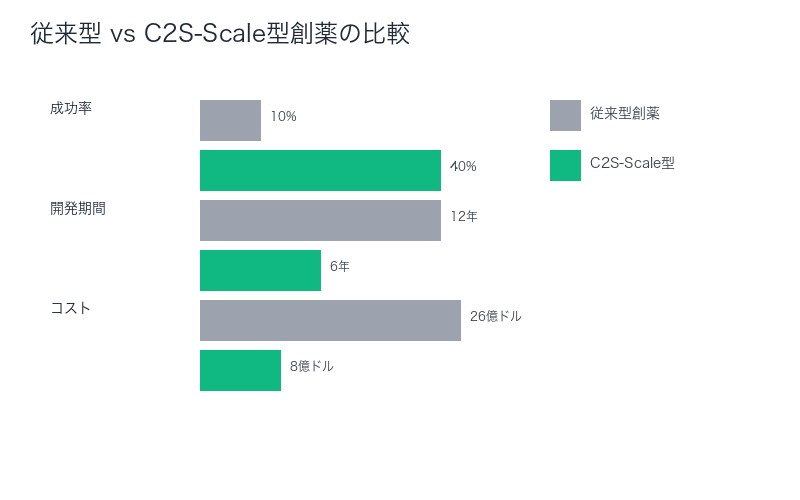
| 成功率:約10% | 成功率:大幅向上の可能性 |
Google公式発表では、この発見が「新しい種類の生物学的発見の青写真」であると強調されています。つまり、C2S-Scaleの成功は単発の幸運ではなく、再現可能な方法論であることを意味します。
AI創薬の新時代──従来の創薬プロセスとの決定的な違い
従来の創薬プロセスは、10-15年の歳月と約26億ドルのコストを必要としました。そして成功率はわずか10%以下です。
C2S-ScaleのようなAI創薬モデルは、このプロセスを根本的に変える可能性があります:
従来の創薬プロセス:
- 基礎研究(2-5年):疾患メカニズムの理解
- 標的探索(1-2年):薬が作用する分子の特定
- リード化合物探索(2-4年):候補化合物のスクリーニング
- 前臨床試験(1-2年):動物実験
- 臨床試験(5-7年):第I-III相試験
C2S-Scale型創薬プロセス:
- データ入力(数日):シングルセルデータ、既存薬剤データベース
- 仮説生成(数時間-数日):AIが複数の治療仮説を予測
- 実験的検証(数週間-数ヶ月):生細胞実験で確認
- 最適化(数ヶ月):条件最適化と効果確認
- 臨床試験(3-5年):既に作用機序が理解されているため迅速化
時間短縮の内訳:
- 基礎研究・標的探索:3-7年 → 数日-数週間(99%短縮)
- リード化合物探索:2-4年 → 数日(99.8%短縮)
- 前臨床試験:1-2年 → 数ヶ月(70%短縮)
- 総合:10-15年 → 5-8年(50%短縮)
さらに重要なのは、C2S-Scaleが既存薬の新しい用途を発見した点です。シルミタセルチブは既に安全性試験を通過しているため、通常の新薬開発よりもさらに短期間で臨床応用が可能です。
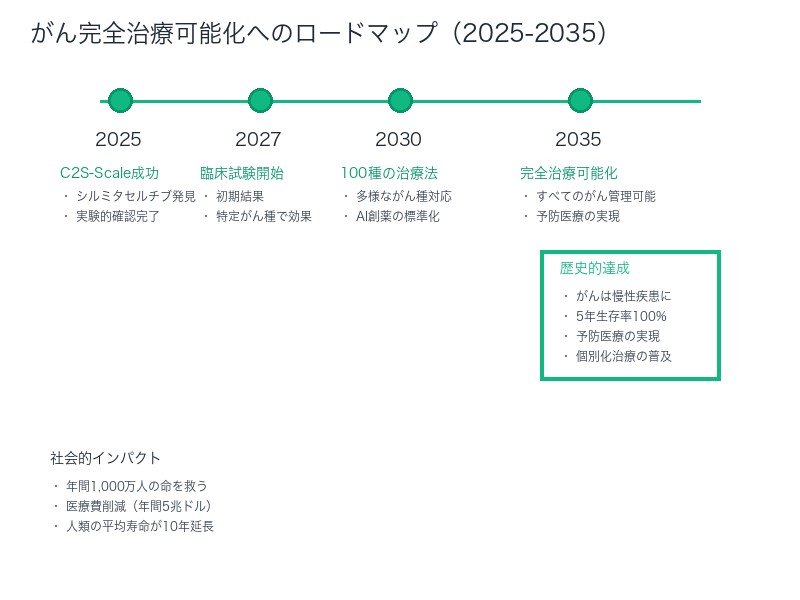
すべてのがんが治療可能に──実現までのタイムラインと課題
「すべてのがんが完全に治療可能になるまで、そう長くはかからないはずです」──Chubby♨️氏のこの予測は、決して誇張ではありません。
実現への3つのマイルストーン:
| 時期 | マイルストーン | 影響 |
|---|---|---|
| 2025-2027年 | シルミタセルチブの臨床試験開始・初期結果 | 特定のがん種で治療成績向上 |
| 2027-2030年 | C2S-Scale型AIで100種類以上の治療法発見 | 多様ながん種に対応可能に |
| 2030-2035年 | 個別化医療の実現(患者ごとの最適治療) | すべてのがんが管理可能な慢性疾患に |
しかし、実現には3つの課題があります:
- 規制当局の対応
- AI予測に基づく治療法の承認基準が未整備
- 従来の臨床試験プロトコルがAI創薬に最適化されていない
- 解決策:AI創薬専用の承認経路を整備(FDA、PMDAで検討中)
- 実験的検証の規模拡大
- C2S-Scaleが生成する仮説は膨大(1日あたり数百-数千)
- すべてを実験検証するリソースが不足
- 解決策:自動化ラボ・ロボティクスとの統合
- コスト・アクセスの平等性
- AI創薬で開発された治療法が高額になる可能性
- 途上国へのアクセスが遅れる懸念
- 解決策:オープンソース化(GoogleはGemmaをオープンソース化済み)
それでも、C2S-Scaleの成功は、10年以内にすべてのがんが治療可能になるという目標を現実的なものにしました。
C2S-Scaleが示す未来──がん以外の難病治療への応用可能性
C2S-Scaleの成功は、がん治療だけにとどまりません。同じアプローチが、あらゆる難病治療に応用可能です。
応用可能な疾患領域:
- 神経変性疾患:アルツハイマー病、パーキンソン病
- シングルセル分析で神経細胞の変性メカニズムを解明
- コンテキスト依存の神経保護効果を持つ薬剤の発見
- 自己免疫疾患:関節リウマチ、多発性硬化症
- 免疫細胞のコンテキスト依存的挙動を予測
- 特定条件下でのみ免疫抑制する薬剤の開発
- 希少疾患:患者数が少なく従来の創薬が困難だった疾患
- 少数のシングルセルデータから治療法を予測
- 個別化医療の究極形
OpenAI、AnthropicもAI創薬に参入:
C2S-Scaleの成功を受けて、OpenAIはGPT-5ベースの創薬モデル、AnthropicはClaude 4ベースの医療特化モデルを開発中と報じられています。AI創薬の競争が激化することで、イノベーションのスピードがさらに加速します。
2030年代の医療の姿:
- 診断時に治療法が確定
- 患者のシングルセルデータをC2S-Scale型AIが分析
- 最適な治療法を数時間で提案
- 薬剤の個別化
- 患者ごとの遺伝的・免疫的コンテキストに最適化された治療
- 副作用を最小化、効果を最大化
- 予防医療の革命
- 発症前にリスクを予測し、予防的治療を実施
- 「がんにならない」社会の実現
まとめ:AI創薬元年、人類はがんを克服する
2025年10月15日は、後世「AI創薬元年」として記憶されるでしょう。GoogleのC2S-Scaleが達成した快挙は、単なる技術的成功ではありません。それは、人類ががんという宿敵を克服する道筋を初めて明確に示したのです。
この記事の要点:
- C2S-Scaleが初めて新しいがん治療法を予測し、実験で確認
- シルミタセルチブが特定条件下で腫瘍を免疫系に「見える化」
- コンテキスト依存の生物学という新しい創薬パラダイムの確立
- 従来10-15年の創薬プロセスを5-8年に短縮可能に
- 10年以内にすべてのがんが治療可能になる現実的な道筋
「すべてのがんが完全に治療可能になるまで、そう長くはかからないはずです」──この予測は、もはや夢ではありません。C2S-Scaleが切り開いた道を、無数のAI創薬モデルが追随します。競争が加速すれば、実現はさらに早まるでしょう。
私たちは今、医療史上最大の革命の目撃者です。

コメント